肺高血圧症の病態の解明、診断能と治療成績の向上、および治療指針の確立をはかり、貢献することを目的として活動を行っております
本学会について
2025年度 日本肺高血圧・肺循環学会「八巻賞」受賞者
2025年度 日本肺高血圧・肺循環学会「八巻賞」受賞者および受賞研究題目
赤木 達(岡山大学学術研究院医歯薬学域 循環器内科学)
「肺動脈性肺高血圧症治療の新展開を導く臨床的挑戦と基礎研究」
研究要旨
「シャント性心疾患に伴う肺動脈性肺高血圧症(PAH)に対するTreat and Repair strategyの確立」
心房中隔欠損症(ASD)や心室中隔欠損症(VSD)などのシャント性心疾患はPAHの原因である。PAHが軽度ならシャント閉鎖が可能だが、中等度以上ならシャント閉鎖は困難である。しかし中等度以上のPAHでも肺血管標的薬でPAHが改善し、シャント閉鎖が可能となる症例が散見される。このように肺血管標的薬でPAH改善後にシャント閉鎖する治療方針をTreat and Repair strategyといい、我々はASD-PAHに対するTreat and Repair strategy(Circ J. 2016)、VSD-PAHに対するTreat and Repair strategy(Eur Heart J Case Rep. 2018, J Cong Cardiol. 2020, J Cardiol Cases. 2021)を実践してきた。しかしエビデンスがなくその評価は定まっていない。
我々は中等度以上のASD-PAH及びVSD-PAHに対するTreat and Repair strategyを完遂できた症例と完遂できなかった症例を比較し、その有用性を報告した(JACC advances. 2024)。当院のASD 758例、VSD 27例のうち、mPAP 25mmHg以上、PVR 5 wood units以上の25例に対しTreat and Repairを試みた。20例でTreat and Repairを完遂できたが、5例はできなかった。完遂群では、最終的にmPAPが53±13 mmHgから29±12 mmHg、PVRが9.6±2.6 WUから5.0±3.4 WUへ低下した(図1)。一方非完遂群では、肺血管標的薬でmPAPが75±13 mmHgから72±15 mmHgと変化なく、PVRも27±6 WUから18±4 WUと高値のままだった。
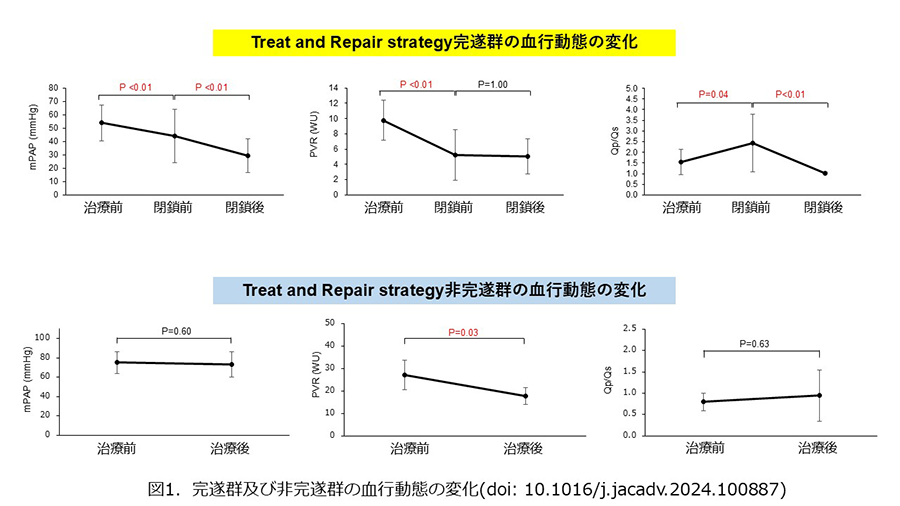
完遂群は非完遂群と比べて有意な予後改善を認め(図2)、診断時のmPAP低値、PVR低値、肺体血流比(Qp/Qs)≧1、酸素飽和度≧90%がTreat and Repair完遂の予測因子であった。
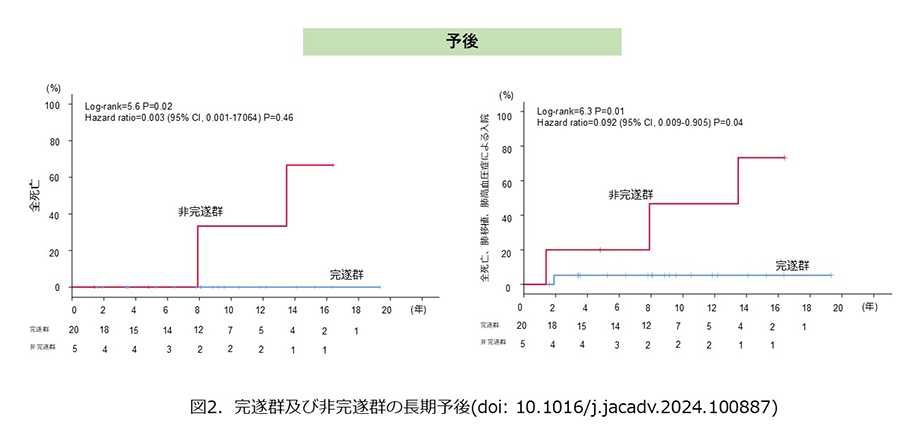
中等度以上のシャント性心疾患に伴うPAHの多くは、アイゼンメンジャー症候群へと進展し予後不良となる。本結果はTreat and Repair strategyを実践する上で重要な知見であり、シャント性心疾患に伴うPAHの治療向上に貢献する。
「PAH患者由来肺動脈平滑筋細胞(PAH-PASMCs)を用いた新規治療法の探索」
当施設は肺移植患者由来のPAH-PASMCsを用いて基礎研究を行ってきた。PGI2の高用量療法が著しいmPAPの低下をもたらしたため(Circ J. 2010)、PGI2は肺血管拡張作用以外の効果を持つと考えられた。そこで実験的にPAH-PASMCsにPGI2を投与すると、FASリガンドを介してPAH-PASMCsのアポトーシスが誘導された(Int J Cardiol. 2013)。実際PGI2を高用量投与された症例の肺血管では、PGI2非投与と比べて中膜肥厚が軽く(JC Cases. 2014)、PGI2がPAH-PASMCsのアポトーシスを誘導し肺血管リモデリングを改善させると考えられた。一方でPGI2は半減期が短くカテーテルによる持続投与が必要なため、カテーテル関連合併症やQOL低下が懸念される。そこで標的臓器への取り込み効率を上昇し、局所的かつ徐放的に薬剤を放出させ、多様な投与方法を可能とするナノドラッグデリバリーシステム(DDS)をPAH治療に応用できないか実験的に検証した。PGI2封入ナノDDSを肺高血圧ラットに気管内投与すると右室圧の低下、肺血管中膜肥厚度や生存率の改善がみられ、PGI2のみより長期にわたってPAH-PASMCsの増殖抑制効果が続いた(図3)(Cardiovasc Pharmacol. 2016)。
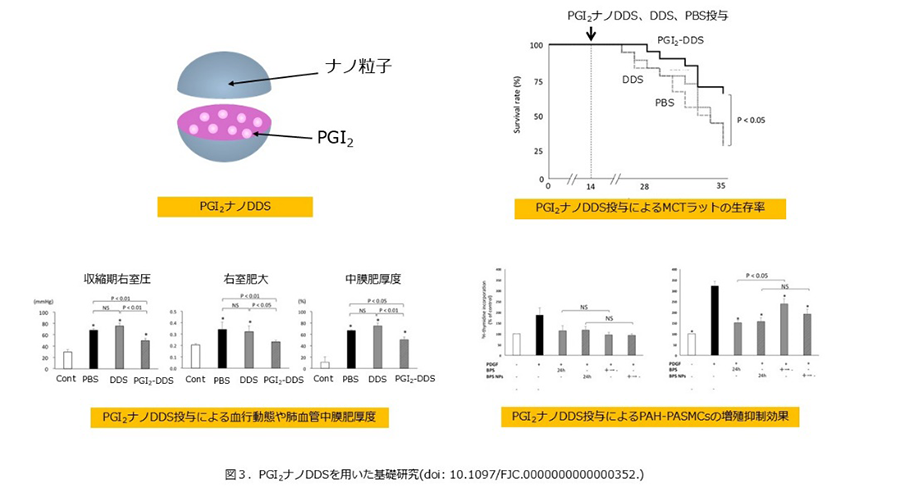
PGI2封入ナノDDSは従来のPGI2投与での懸念点を解決し、ナノDDSの局所的かつ徐法的な薬剤放出という特性から高用量投与を可能とし、治療効果を最大限に発揮させうる。有効性、副作用、用量の点からPAH治療薬として未認可になったイマチニブを封入したナノDDSでも同様の結果が得られており(Int Heart J. 2015)、ナノDDSの特性を生かした新規PAH治療法の臨床応用を目指している。また最近はPAHと尿酸及びURATv1の関係を明らかにした基礎研究(Eur Respir J. 2021)やPAH-PASMCsのエネルギー代謝に関する基礎研究(J Clin Med. 2023)を論文として発表し、多面的にPAHの病態形成の解明に取り組んでいる。
